第三臨床醫學院李學文課題組探討Apelin-13對AngII誘導的HL-1心房肌細胞的保護作用
2020年9月���,第三臨床醫學院李學文課題組在Physiological Research 雜志上發表了題為“Apelin-13 regulates angiotensin II- induced Cx43 downredulation and autophagy via the AMPK/mTOR signaling pathway in HL-1 cells”的研究論文����,在體外建立Angiotensin II (AngII) 誘導的HL-1心房肌細胞重構模型�����,研究Apelin-13調控AngII誘導的HL-1細胞Connexin 43 (Cx43)重構和細胞肥厚的作用機制。
房顫(Atrial Fibrillation, AF)作為一種常見的心律失常�����,具有高發病率和死亡率(Sumeet et al.2014)����。縫隙連接43(Connexin43, Cx43)是心肌縫隙連接中表達最多的主要縫隙連接蛋白(Xiao et al. 2016)���。Cx43拓撲結構的改變或大部分由表達決定心臟組織電屬性的通道數量的改變會促進心律失常包括AF的發生�����。已有研究發現Cx43重塑可以促進豚鼠心臟AF的發展����,同樣的結論在AF患者中也被發現(Shinohara et al. 2017)�����。因此����,調控Cx43的保護性治療可能是應對房顫的新策略。早在1998年���,Tatemoto等發現牛胃中有一種蛋白激素Apelin-13����,并在后續的研究中發現其具有直接或者間接影響心血管生理的多種生物學功能(Tatemoto et al. 1998)�����。同時���,實驗發現����,AF患者的血Apelin水平比正常人低���。低Apelin水平的AF患者數量比高Apelin水平的AF患者數量多三倍(Falcone et al. 2010)。并且Apelin-13可以抑制高糖條件下的心肌Cx43下調(Li et al.2018)���。此外����,AF患者循環血液中的腦鈉肽(BNP)明顯增加�����,用慢性BNP治療快速心房起搏(RAP)兔和快速區域性刺激的HL-1細胞可以改善心房電重塑(zhao et al. 2019)�����。但是,Apelin在AF中的保護性機制目前研究較少���。
因此�����,本課題建立AngII誘導的HL-1細胞模型���,探究AngII誘導HL-1細胞模型Cx43下調的最適濃度(10uM)和Apelin-13干預的最適濃度(100nM)�����。實驗結果發現���,單獨使用AngII處理HL-1細胞�����,Cx43表達明顯下降,單獨使用Apelin-13對Cx43表達無明顯影響�����,但Apelin-13和AngII合用時,Apelin-13可以明顯改善AngII誘導的Cx43表達(圖1)���。


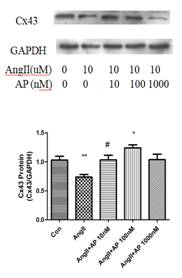
圖1. Apelin-13和AngII對HL-1細胞Cx43表達的作用
李學文課題組進一步探究Apelin-13的作用機制����,用CompoundC(AMPK抑制劑)或者Rapamycin(mTOR抑制劑)與Apelin-13共同處理模型細胞�����,探討AMPK/mTOR通路在Apelin-13調控AngII誘導HL-1細胞Cx43下調和心肌肥厚的機制(圖2)�����。結果顯示���,Apelin-13可以通過激活AMPK/mTOR通路逆轉AngII誘導的HL-1細胞Cx43重構和細胞肥厚�����。
A.
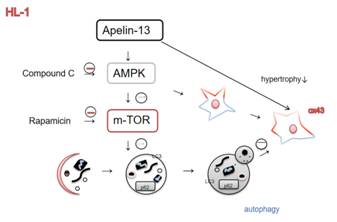
B. C.
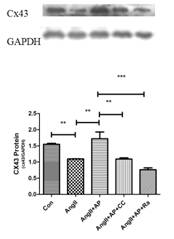

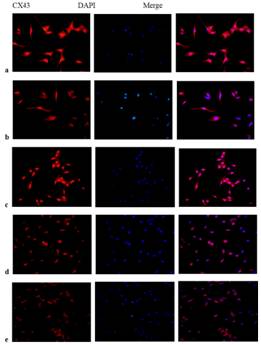
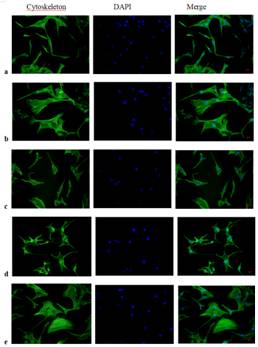
圖2����:Apelin-13調控AngII誘導的HL-1細胞Cx43重構和肥厚的機制
該實驗首次發現Apelin-13可以通過激活AMPK/mTOR通路逆轉AngII誘導的HL-1細胞Cx43下調和肥厚,進而對臨床房顫的預防和治療提供新的可能�����。未來將進一步探討Apelin-13在在體和人體中的保護性機制����。
c7c7.app第三臨床醫學院心內科李學文和c7c7.app病理學與病理生理學教研室的劉清華是共同通信作者����,c7c7.app第三臨床醫學院心內科的陳奕帆是第一作者���。該工作獲得山西省研究生教育創新項目資助���。