第二臨床醫學院神經內科薛國芳課題組首次觀察到新型GLP-1/GIP雙受體激動劑DA3-CH具有抑制癲癇發生的神經保護作用

圖1
薛國芳課題組首次觀察到新型GLP-1/GIP雙受體激動劑DA3-CH具有抑制癲癇發生的神經保護作用���,研究成果“The novel GLP-1/GIP dual receptor agonist DA3-CH is neuroprotective in the pilocarpine-induced epileptogenesis rat model”于2019年5月7日收錄于《Epilepsy Research》(圖1)����。
癲癇是最常見的神經系統疾病之一��������,影響全球高達1%的人口������。發達國家的終身癲癇發病率中位數為5.8‰����,發展中國家為10.3‰���������。癲癇由多種多樣的病因引起�������,表現為大腦神經元超興奮性和超同步性異常放電��������,以自發性復發性癲癇發作(recurrent spontaneous seizures, SRS)為特征��������。癲癇持續狀態(status epilepticus , SE)是癲癇發作最嚴重的形式���,易誘發癲癇發生�����,進展為慢性癲癇,出現SRS����。癲癇發作指一簇神經元過度放電激發的一次短暫臨床發作�����,而癲癇發生指致癇灶形成和成熟的慢性過程����������。目前可獲得的臨床一線抗癲癇藥物(antiepileptic drugs, AEDs)對近三分之一的癲癇患者無效或產生不可耐受的副作用���������,其主要干預神經元功能�������,調控突觸興奮和突觸抑制����,僅可控制癲癇發作����,并不能阻止癲癇發生�������。因此��,抑制癲癇發生可能是一種潛在的新型治療策略���。
癲癇發生被定義為大腦由正常生理狀態轉變為致癇狀態的慢性動態演變過程����,其可由多種初始事件或危險因素誘發�������,例如癲癇持續狀態������、創傷性腦損傷�����、腦卒中、感染和化學神經中毒等����,經過復雜多樣的病理生理學變化����������,最終導致局部神經元結構和功能紊亂��������,致癇灶逐漸成熟���������,形成慢性癲癇�����。傳統AEDs 的分子靶點為抑制神經元的異常放電及擴散��������,并不能阻止神經元破壞的病理過程��,而后者是導致 SRS 的原因������?;趧游锛叭祟惏d癇的研究�����,癲癇發生的病理生理學動態變化包括離子通道激活��������、炎癥和神經膠質反應���������、興奮毒性細胞凋亡、血腦屏障破壞��������、表觀遺傳失調��、神經變性和軸突生芽�����、苔蘚纖維發芽�������、原纖維性神經膠質增生�����、海馬硬化等����。其中��������,神經炎癥反應和細胞凋亡屬癲癇發生的始動因素���,且參與癲癇發生的整個過程�����,在癲癇發生中具有關鍵作用������。
胰高血糖素樣肽-1(glucagon-like peptide-1, GLP-1)和葡萄糖依賴性促胰島素樣肽(glucose-dependent insulinotropic polypeptide, GIP)均屬腸促胰島素����,可促進胰島素分泌���������,抑制胰高血糖素分泌���,其類似物已用于2型糖尿病的治療��������,且其降糖作用呈葡萄糖依賴性��������。近年的研究發現�������,GLP-1和GIP還具有神經保護作用�����,在卒中�������、阿爾茨海默����������。ˋlzheimer's disease, AD)�����、帕金森��������。Parkinson's disease, PD)等神經系統疾病動物模型中可通過抑制神經膠質細胞激活和促炎因子釋放�、抑制氧化應激和細胞凋亡等方面發揮神經保護作用����������,且GLP-1/GIP雙受體激動劑的作用優于選擇性單受體激動劑�。
研究采用經典的匹羅卡品SE模型誘發癲癇發生��������,給予新型GLP-1/GIP雙受體激動劑DA3-CH進行干預�����,通過免疫組織化學和蛋白印跡分析方法檢測SE后12h����、1d��������、3d����、7d大鼠尾靜脈空腹血糖水平以及海馬中星形膠質細胞激活標志物膠質纖維酸性蛋白(glial fibrillary acidic protein, GFAP)����������、小膠質細胞激活標志物離子鈣接頭分子-1(ionized calcium-binding adaptor molecule-1, Iba-1)���������、促炎因子白細胞介素-1β(interleukin-1β, IL-β)和腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)�������、凋亡相關蛋白Bax和Bcl-2����、神經元核抗原NeuN(neuronal nuclei)的表達水平���������,評估DA3-CH對大鼠SE后神經炎癥反應�����、細胞凋亡和神經元丟失的影響�����。研究結果表明�������,DA3-CH干預對非糖尿病大鼠血糖水平無影響(圖2)�,且可抑制SE后GFAP���、Iba-1�����、IL-1β���������、TNF-α�����、Bax的表達������,同時促進SE后Bcl-2�������、NeuN的表達(圖3-6)���。研究結果表明�������,新型GLP-1/GIP 雙受體激動劑 DA3-CH 可抑制匹羅卡品誘導的大鼠SE后神經炎癥反應、細胞凋亡和神經元丟失��������,具有抑制癲癇發生的潛在神經保護作用����,可能為探索抑制癲癇發生的新型治療策略提供實驗基礎���������。
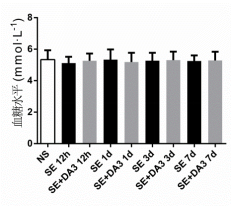
圖2各組大鼠空腹尾靜脈血糖水平

圖3各組大鼠海馬CA1區GFAP陽性細胞數及免疫組織化學圖片(×200)

圖4各組大鼠海馬CA1區Iba-1陽性細胞數及免疫組織化學圖片(×200)

圖5各組大鼠海馬CA1區NeuN陽性細胞數及免疫組織化學圖片(×200)

圖6各組大鼠海馬組織GFAP�������、Iba-1����、IL-1β����������、TNF-α�、Bax������、Bcl-2和NeuN相對OD值及western blot蛋白條帶
薛國芳副主任醫師為通信作者�����,田淼晶碩士為第一作者�������,王瑞芳碩士��������、Christian H?lscher教授��������、米茹麟碩士���������、袁振宇碩士及李東芳主任醫師為共同作者����。本課題承蒙國家自然科學基金和中國抗癲癇協會癲癇科研基金-UCB基金等資助。